Для начала давайте все-таки удостоверимся, что кислотность – это не тоже самое, что и вкус, и у разных продуктов разная. Возьмем молоко, газировку, питьевую воду, сок томатный, молоко, кофе, боржоми и измерим кислотность - показатель pH с помощью
- Вода питьевая – даст показатель близкий к 7
- Вода газированная – будет слабокислая, за счет растворенного в воде углекислого газа, который дает углекислую кислоту.
- Кока-кола – покажет кислый рН, около 3
- Кофе - кислый, его показатель кислотности будет равен примерно 5
- Молоко – близко к нейтральному - 7, но здесь несколько сложнее, так как молоко - это эмульсия типа масло в воде, какая вода, такая и среда
- Сок томатный – даст pH около 4
- Боржоми – близко к 7, или чуть больше 7
Можно даже устроить викторину, чтобы участники до измерений предложили свои варианты показателей pH для представленных напитков, тому, кто верно назовет большее количество, тому стакан полезного молока.
Убедились? Да, даже не кислые на вкус продукты характеризуются повышенной кислостностью.
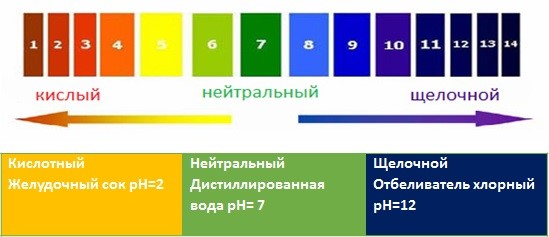
И вот опять легко оперируем названиями – кислая среда, нейтральная, щелочная? pH равен 7 значит нейтральная, а почему не 8 или не 5? Тут тоже все не очень сложно, если разобраться. Дело началось с воды, формулу которой мы, пожалуй, узнаём самой первой – Н2О. Из уравнения диссоциации понятно, что вода может обладать как кислотными, так и основными свойствами. На всякий случай ниже про ионное произведение воды, чтобы уж точно было понятно почему шкала pH от 1 до 14.*
Ну это все были развлечения для привлечения внимания к проблеме понятия кислотности, а теперь самое интересное.
Попросите учеников приготовить пять растворов соляной кислоты таким образом.
Сначала надо вылить 10 мл 0,1 М HCl в пробирку.
Далее используя градуированные цилиндры и пипетки, они могут добавить 1 мл этого раствора в другую пробирку с 9 мл воды, образуя 0,01 М раствор.
Затем они должны повторить процесс: брать из предыдущей пробирки 1 мл раствора и добавлять в следующую с 9 мл воды до тех пор, пока не будет 5 пробирок. Собственно, метод серийного разведения в действии.
Следующим этапом следует добавить универсальный индикатор, так чтобы он окрасил наши растворы соляной кислоты. Цвет изменился, но различить можно только пятый, самый слабый раствор, если сравнить его цвет с цветовой школой pH, то видимо, показатель кислотности раствора равен 5. Тогда как различить показатели первых четырех растворов не получается, индикатор показывает, что они все примерно равны 3.

Очевидно, индикатор не совсем справляется, мы ведь точно знаем, что концентрация соляной кислоты в каждой пробирке разная, имеет смысл провести измерения используя новейшие технологии
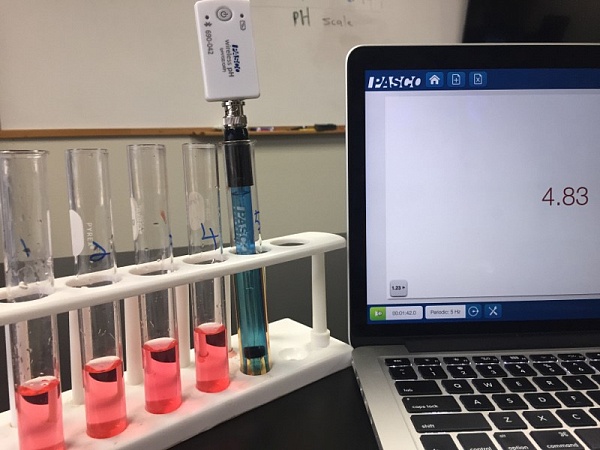
Чтобы было наглядно и ничего не упустить, лучше всего составить таблицу и записать данные о молярной концентрации математически.
Теперь ведь совершенно очевидно, что показатель pH во-первых, не имеет единиц измерения, а во-вторых, равен обратному десятичному логарифму концентрации ионов водорода! Очень наглядно с помощью серийного разведения, математической записи молярности и измерений с помощью можно объяснить казалось бы такое сложное на первый взгляд понятие как кислотность.
Теперь уже совершенно спокойно можно продолжить экспериментировать и с концентрацией гидроксидионов. Возьмите 0.1М раствор NaOH и пять пробирок…

*про ионное произведение воды. Уравнение диссоциации воды показывает, что вода может обладать как кислотными так и основными свойствами
H2O ? H+ + OH—
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H+]·[OH—]/[H2O]
Концентрация недиссоциированной воды практически постоянна и ее можно исключить из уравнения. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды :
KН2О = [H+]·[OH—]
При температуре 25?С KН2О = 1·10-14 и остается постоянной в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H+]·[OH—] = 1·10-14
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным и, очевидно, что концентрации ионов водорода [H+] и гидроксид-ионов [OH?]составляют 10?7 моль/л.
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении увеличении концентрации ионов водорода, концентрация гидроксид-ионов соответственно уменьшается, и наоборот, Константа при этом остается равной 1·10-14 . Когда [H+] > [OH?] говорят, что раствор является кислотным, а при [OH?] > [H+] — основным или щелочным.



Авторизуйтесь, чтобы оставить комментарий.